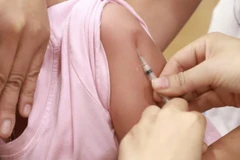
Khám cho trẻ trước khi tiêm chủng. (Ảnh: TTXVN/Vietnam+)
Khám cho trẻ trước khi tiêm chủng. (Ảnh: TTXVN/Vietnam+)Chiều tối 28/12, Bộ Y tế đã cung cấp thông tin ban đầu về trường hợp 2 trẻ tử vong tại nhà sau tiêm chủng.
Theo thông tin từ Bộ Y tế, mới đây tại tỉnh Nam Định, có hai trường hợp trẻ tử vong tại nhà sau tiêm chủng từ 36 đến 48 tiếng.
Hai trẻ đều được khám sàng lọc và tiêm vắcxin ComBE Five, uống vắcxin bại liệt tại trạm y tế. Sau tiêm được theo dõi 30 phút tại trạm đúng quy định và không có biểu hiện bất thường.
[Triển khai tiêm vắcxin ComBE Five trên toàn quốc từ cuối tháng 12]
Sau khi về nhà, trong vòng một đến hai ngày trẻ có biểu hiện sốt nhẹ, gia đình tự cho uống thuốc hạ sốt, không đưa đến cơ sở y tế.
Sang ngày hôm sau, gia đình thấy trẻ tím tái, khó thở nên đưa cháu đến bệnh viện huyện. Tuy nhiên, khi tới bệnh viện hai cháu đã tử vong.
Sở Y tế Nam Định đã tiến hành điều tra nguyên nhân và họp Hội đồng Tư vấn chuyên môn đánh giá nguyên nhân.
Hội đồng đã có kết luận hai trường hợp trẻ tử vong sau tiêm chủng không nghĩ đến phản ứng phản vệ nặng sau tiêm vắcxin, không liên quan đến thực hành tiêm chủng và Hội đồng tư vấn chuyên môn xác định trẻ tử vong chưa rõ nguyên nhân.
Về việc triển khai tiêm vắcxin mới thay thế vắcxin Quinvaxem, đại diện Chương trình tiêm chủng mở rộng quốc gia cho biết, Bộ Y tế tiếp tục chỉ đạo các tỉnh/thành phố thực hiện tiêm vắcxin ComBE Five theo kế hoạch, thực hiện đúng quy trình tiêm chủng an toàn, khám sàng lọc, theo dõi 30 phút tại trạm sau tiêm, tư vấn cho các bậc cha mẹ biết cách theo dõi và chăm sóc trẻ sau tiêm chủng.
Khi trẻ có biểu biện bất thường về sức khỏe như sốt cao trên 39 độ C, quấy khóc kéo dài, tím tái, phát ban, ly bì…các bà mẹ phải đưa trẻ đến ngay cơ sở y tế gần nhất để khám và điều trị.
Vắcxin phối hợp 5 trong 1 (Quinvaxem) phòng bệnh Bạch hầu, ho gà, uốn ván, viêm gan B, viêm phổi, viêm màng não mủ do vi khuẩn Hib đã được đưa vào chương trình tiêm chủng mở rộng Việt Nam từ tháng 6 năm 2010.
Từ tháng 10 năm 2016, nhà sản xuất thông báo ngừng sản xuất vắc xin Quinvaxem trên quy mô toàn cầu.
Để đảm bảo tiêm chủng phòng các bệnh nêu trên cho trẻ em, được sự khuyến cáo của Tổ chức Y tế thế giới (WHO) và Liên minh tiêm chủng vắc xin toàn cầu (GAVI), Bộ Y tế xem xét đã có Quyết định về việc sử dụng vắc xin ComBE Five do Công ty Biological E. Ltd Ấn Độ sản xuất có thành phần tương tự để thay thế vắcxin Quinvaxem.
Sau khi triển khai trên quy mô nhỏ tại 7 tỉnh (Hà Nam, Bắc Giang, Yên Bái, Kon Tum, Bình Định, Đồng Tháp, Bà Rịa Vũng Tàu) trong tháng 10 và tháng 11/2018 với tổng số trẻ được tiêm là 17.356 trẻ.
Bộ Y tế đã chỉ đạo triển khai trên quy mô toàn quốc từ tháng 12/2018. Đến ngày 27/12/2018, đã có 12 tỉnh triển khai tiêm vắc xin ComBe Five đã được triển khai.
Theo báo cáo của các địa phương, ngoài phản ứng thông thường như (sốt nhẹ, sưng đau nhẹ tại chỗ tiêm, các triệu chứng khác như khó chịu, quấy khóc...) ghi nhận một số trường hợp sốt cao, quấy khóc kéo dài ở Thái Bình, Nam Định, Hà Nam, Bình Định, Quảng Ngãi, Kon Tum với tỷ lệ khoảng 0,05% - 5,5%, các trường hợp này đều đã ổn định sau khi được cán bộ y tế theo dõi, điều trị.
Các địa phương còn lại sẽ triển khai vào ngày tiêm chủng thường xuyên trong tháng 1 năm 2019.
Theo tài liệu của Tổ chức Y tế Thế giới, tỷ lệ phản ứng thông thường đối với các vắcxin chứa thành phần ho gà toàn tế bào, trong đó có vắcxin ComBE Five: sốt từ 38-39°C chiếm tới 44,5%, phản ứng sưng 38,5%, nóng đỏ tại chỗ tiêm có thể tới 56,3%, đau 25,6%, các phản ứng khác như quấy khóc kéo dài là 3,5%./.